Внутренняя энергия является важным понятием в физике и химии. Она представляет собой сумму всех видов энергии, присутствующих в веществе. Увеличение внутренней энергии может иметь различные причины и осуществляться различными механизмами, и изучение этих процессов является ключевым для понимания многих явлений в природе.
Одним из принципов увеличения внутренней энергии является теплообмен. При нагревании внешнее тепло передается веществу, в результате чего его частицы начинают двигаться более энергично. Значительное количество энергии может быть поглощено и выделино за счёт этого процесса.
Другим важным механизмом увеличения внутренней энергии является работа. Когда на вещество действует сила, оно может совершить работу, и энергия будет передана системе. Например, при сжатии газа объем его внутренних частиц уменьшается, и они приобретают дополнительную энергию.
Принципы увеличения внутренней энергии

1. Передача тепла: Энергия может передаваться из одной системы в другую в виде тепла. При этом внутренняя энергия системы увеличивается из-за увеличения кинетической энергии молекул.
2. Выполнение работы: При выполнении работы внешними силами над системой происходит увеличение ее внутренней энергии. Это может произойти, например, при сжатии газа или поднятии предмета.
3. Химические реакции: Внутренняя энергия системы может увеличиваться или уменьшаться в результате химических реакций. При этом изменяется энергия связей между атомами и молекулами.
4. Ядерные реакции: В ядерных реакциях происходит изменение структуры атомного ядра, что приводит к большим изменениям внутренней энергии системы.
5. Электромагнитное излучение: Встречное взаимодействие световых квантов (фотонов) и молекул системы может привести к переходу энергии от света к молекулам и, соответственно, к увеличению их внутренней энергии.
Внутренняя энергия является основной характеристикой термодинамической системы и позволяет оценить ее состояние. Увеличение внутренней энергии может быть полезным, например, для создания рабочей среды в паровых или газовых турбинах. Однако, также необходимо уметь контролировать и управлять этим процессом, чтобы избежать нежелательных последствий, таких как перегрев или разрушение системы.
Тепловое взаимодействие и количественная характеристика
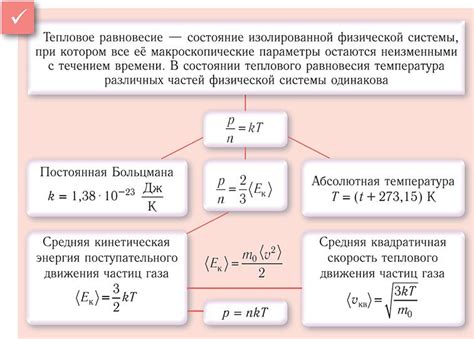
Количественная характеристика теплового взаимодействия определяется понятием теплоты, которая является энергией, передаваемой между системами вследствие разности их температур. Теплота измеряется в джоулях (Дж) или калориях (кал).
Для определения количества теплоты, переданного между системами, используется формула:
𝑄 = 𝑚𝑐Δ𝑡
где 𝑄 - количества теплоты, переданной между системами;
𝑚 - масса вещества, участвующего в тепловом взаимодействии;
𝑐 - удельная теплоемкость вещества;
Δ𝑡 - изменение температуры.
Удельная теплоемкость - это величина, определяющая количество теплоты, необходимое для изменения температуры единицы массы вещества на единицу температурного интервала.
Таким образом, зная массу вещества, его теплоемкость и изменение температуры, можно рассчитать количество теплоты, переданное между системами в процессе теплового взаимодействия.
Работа и ее влияние на внутреннюю энергию
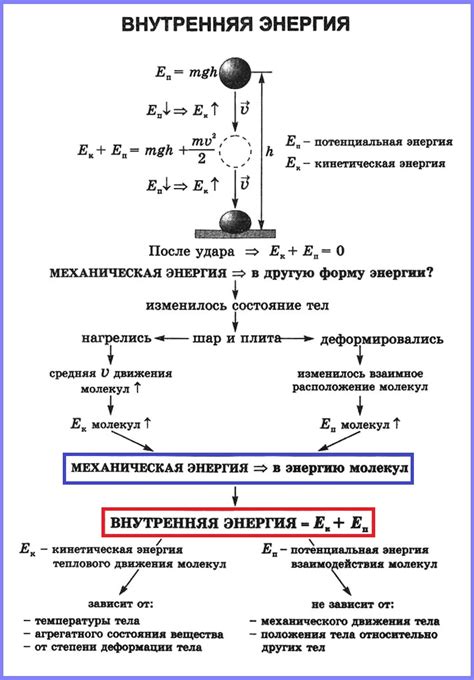
При выполнении работы происходит преобразование энергии и переход ее из одной формы в другую. Например, в механической работе энергия может быть переведена из формы кинетической энергии движущегося тела в потенциальную энергию, преодолевающую силу тяжести или силу сопротивления. В результате выполнения работы в системе происходят изменения внутренней энергии, связанные с физическими и химическими процессами, распределением и преобразованием энергии.
Влияние работы на внутреннюю энергию системы зависит от особенностей процесса и условий окружающей среды. Так, в окружающей среде могут происходить процессы обмена теплом или выполнение других работ, которые могут изменять внутреннюю энергию системы. Кроме того, работа может зависеть от начального состояния системы и изменений, происходящих в ней.
Таким образом, работа оказывает значительное влияние на изменение внутренней энергии системы и является важным фактором при анализе термодинамических процессов. Понимание принципов и механизмов работы позволяет более точно описывать энергетические процессы системы и их влияние на ее внутреннюю энергию.



