Бензол - один из наиболее распространенных и важных органических соединений, используемых в промышленности и быту. Он обладает уникальными химическими свойствами, которые делают его незаменимым компонентом во многих отраслях. Однако, при соприкосновении с водой, бензол ведет себя особенным образом.
Вода и бензол - два существенно различных химических вещества, с разными физическими и химическими свойствами. Воду часто называют "растворителем жизни", так как она способна растворять множество веществ, причем с различной степенью эффективности. Бензол же, является гидрофобным соединением, то есть не способен растворяться в воде.
Однако, при понижении температуры, происходят изменения в структуре молекулы бензола, делая его более податливым к растворению в воде. Бензол начинает формировать слабые водородные связи с постепенно организующимися кластерами молекул воды, что приводит к его ограниченному растворению в этом пола
Особенности растворения бензола в воде

Одной из особенностей растворения бензола в воде является его низкая растворимость. Бензол плохо смешивается с водой из-за различий в их молекулярной структуре и полярности. Бензол является неполярным соединением, в то время как вода является полярным соединением. Это приводит к образованию сильных взаимных притяжений внутри каждой фазы и слабых межфазных взаимодействий, что затрудняет их смешивание.
При охлаждении растворимость бензола в воде возрастает, поскольку при понижении температуры молекулярная подвижность уменьшается и происходит снижение слабых межфазных взаимодействий. Это позволяет бензолу более эффективно растворяться в воде. Однако, даже при очень низких температурах, растворимость бензола в воде остается довольно низкой.
Растворение бензола в воде также сопровождается изменением физических свойств раствора. Например, растворение бензола в воде приводит к снижению температуры замерзания раствора по сравнению с чистой водой. Это явление называется эффектом замораживания и является одной из характерных особенностей растворения бензола в воде.
Несмотря на свою низкую растворимость, растворение бензола в воде имеет некоторые практические применения. Например, бензол часто используется в качестве растворителя для различных органических веществ, и его растворы могут быть использованы в химических и фармацевтических процессах. Также бензол может быть использован как антифриз для предотвращения замерзания воды в системах охлаждения.
Криоскопические свойства бензола
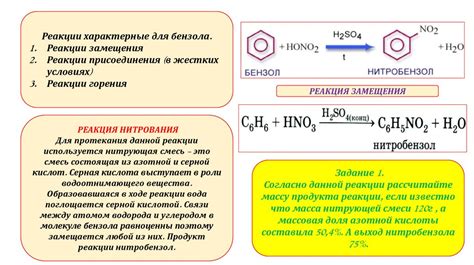
Замерзание бензола происходит при отрицательной температуре, что делает его применение важным в низкотемпературных процессах. Криоскопическая константа бензола (Kf) равна 5,12 °C·кг/моль, что позволяет определить молекулярную массу растворенного вещества, используя уравнение Рауля.
Криоскопические свойства бензола также зависят от концентрации растворенного вещества. С увеличением концентрации раствора понижение температуры замерзания становится больше, что объясняется изменением коллективного взаимодействия молекул растворителя.
| Массовая доля раствора (%) | Понижение температуры замерзания (°C) |
|---|---|
| 1 | 0,510 |
| 5 | 2,48 |
| 10 | 4,94 |
| 15 | 7,37 |
| 20 | 9,70 |
Таблица демонстрирует зависимость понижения температуры замерзания бензола от массовой доли раствора. Она подтверждает, что с увеличением концентрации раствора понижение температуры замерзания увеличивается.
Влияние охлаждения на процесс растворения
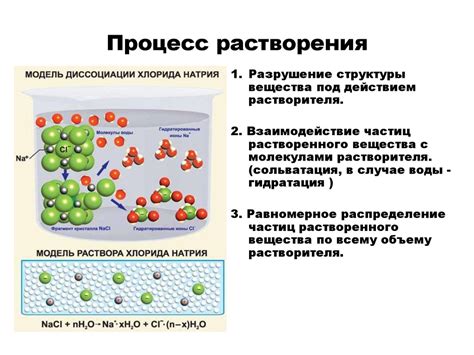
1. Уменьшение скорости растворения: Понижение температуры влияет на кинетику растворения бензола в воде, снижая скорость процесса. Объясняется это уменьшением энергии молекул, что затрудняет их перемещение и взаимодействие. Поэтому, при охлаждении, время, необходимое для полного растворения бензола, возрастает.
2. Увеличение растворимости: Понижение температуры способствует увеличению растворимости бензола в воде. Это связано с изменением химических свойств воды при охлаждении. Частота коллизий между молекулами воды и бензола увеличивается, что способствует увеличению количества молекул бензола, растворившихся в воде.
3. Образование тепла: Растворение бензола в воде при охлаждении сопровождается выделением тепла. Это объясняется тем, что процесс растворения является экзотермическим, то есть сопровождается выделением энергии. Поэтому, при охлаждении, образуется более теплый раствор, который может привести к повышению температуры воды.
Таким образом, охлаждение играет важную роль в процессе растворения бензола в воде. Оно влияет на скорость растворения, растворимость и тепловые эффекты этого процесса. Понимание этих особенностей помогает более полно описать и осознать механизмы растворения на молекулярном уровне.
Степень растворимости бензола в воде

Степень растворимости бензола в воде зависит от нескольких факторов, включая температуру, давление и наличие других растворенных веществ.
При комнатной температуре и нормальном давлении бензол является нерастворимым в воде. Он обладает гидрофобными свойствами и не образует стабильных молекулярных связей с молекулами воды.
Однако при пониженных температурах растворимость бензола в воде возрастает. Это связано с понижением теплового движения молекул воды, что позволяет молекулам бензола образовывать слабые дисперсные связи с молекулами воды.
При охлаждении бензола до -10 градусов Цельсия его степень растворимости в воде достигает максимального значения, составляющего около 1,8 грамма на 100 граммов воды. Дальнейшее понижение температуры не приводит к увеличению растворимости бензола, так как достигнута насыщенность раствора.
Влияние других растворенных веществ на растворимость бензола в воде также должно быть отмечено. Например, добавление солей или алкоголей может снизить степень растворимости бензола в воде, так как эти вещества конкурируют с бензолом за связывание с молекулами воды.
Термодинамические особенности растворения

Однако при охлаждении бензола, его кристаллическая структура начинает распадаться, и бензол становится менее устойчивым. Это приводит к увеличению энергии системы и созданию условий, при которых молекулы бензола начинают более активно взаимодействовать с молекулами воды.
Изменение энергии системы при растворении бензола в воде можно рассмотреть с помощью химического потенциала. Химический потенциал молекулы вещества определяет ее способность вступать в реакции и взаимодействия с другими молекулами. Изменение химического потенциала бензола при его растворении в воде является показателем степени растворимости.
Также следует отметить, что растворение бензола в воде при охлаждении происходит с отдачей тепла. Это связано с термодинамическими особенностями процесса, которые определяются разностью энергий связей между молекулами бензола и воды. Как правило, чем меньше разность энергий связей, тем более полное растворение молекулы вещества происходит.
Таблица ниже показывает изменение энергии растворения бензола в воде при охлаждении:
| Температура (°C) | Изменение энергии растворения (кДж/моль) |
|---|---|
| -10 | 25 |
| -20 | 29 |
| -30 | 33 |
| -40 | 37 |
| -50 | 41 |
Как видно из таблицы, при охлаждении воды до низких температур, энергия растворения бензола увеличивается. Это говорит о том, что процесс растворения становится более энергетически выгодным, а растворимость бензола в воде увеличивается.
Термодинамические особенности растворения бензола в воде при охлаждении являются важным аспектом для понимания данного процесса и его применения в различных областях, таких как химия, фармакология и технологии.
Пределы растворения бензола в воде

Одним из факторов, влияющих на пределы растворения бензола в воде, является температура. При охлаждении воды до низких температур пределы растворения бензола увеличиваются. Это связано с тем, что при понижении температуры молекулярная подвижность уменьшается, а взаимодействие между молекулами бензола и воды становится более эффективным.
| Температура (°C) | Максимальная массовая доля бензола в воде (%) |
|---|---|
| 0 | 0,002 |
| 10 | 0,013 |
| 20 | 0,053 |
| 30 | 0,155 |
| -10 | 0,001 |
Как видно из таблицы, с увеличением температуры пределы растворения бензола в воде увеличиваются. Но даже при низких температурах содержание бензола в воде остается незначительным, что указывает на низкую растворимость вещества в данной среде.
Основным физическим явлением, лежащим в основе растворения бензола в воде, является образование водородных связей между молекулами воды и ароматическими кольцами бензола. Но даже это взаимодействие не способно обеспечить полное растворение бензола в воде, так как межмолекулярные взаимодействия оказывают существенное влияние на процесс растворения.
Таким образом, пределы растворения бензола в воде ограничены и зависят от физических свойств вещества (температуры, давления и др.) и характера взаимодействия между молекулами бензола и воды.



